Baxter informiert: Arzneimittel-Fälschungsschutz-Richtlinie
Baxter begrüßt die neue Richtlinie, da sie Patienten zukünftig noch besser vor Medikamentenfälschungen schützt.
Die neue Arzneimittel-Fälschungsschutz-Richtlinie gilt für verschreibungspflichtige Arzneimittel, die ab dem 09.02.2019 von der Herstellstätte freigegeben werden.
Die Anzahl der bei Baxter betroffenen Produkte ist verhältnismäßig gering.
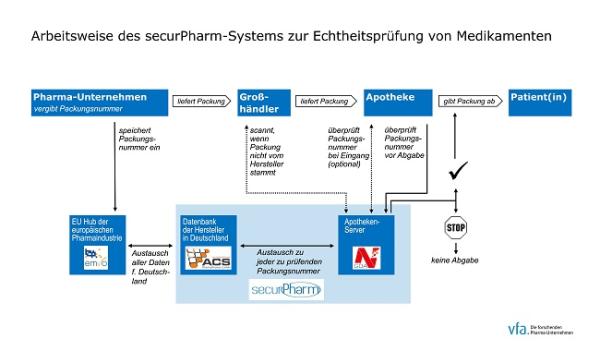
Arbeitsweise des securPharm-Systems bei Medikamenten für den deutschen Markt (Vor-Ort-Apotheke). Quelle: vfa
Unterschleißheim -
Als führender Hersteller von Arzneimitteln und Medizinprodukten begrüßt Baxter die Arzneimittel-Fälschungsschutz-Richtlinie, die im Jahr 2016 von der Europäischen Union erlassen wurde und am 09.02.2019 in Kraft getreten ist. Die neue, starke Allianz - bestehend aus Industrie, Großhändlern, Apotheken und Kliniken in enger Abstimmung mit den Behörden - die durch die neue Richtlinie entsteht, schützt Patienten noch besser vor Medikamentenfälschungen.
Obwohl die neue Richtlinie fast ausschließlich verschreibungspflichtige Arzneimittel umfasst, ist die Anzahl der bei Baxter betroffenen Produkte verhältnismäßig gering, da einige unserer Produktgruppen ausgeschlossen sind. Betroffen sind demnach Produkte aus den Bereichen:
- Anästhesie (Suprane, Sevofluran, Isofluran, Brevibloc)
- Onkologie (Endoxan, Ixoten, Onkotronie, Holoxan, Uromitexan)
- Chirurgie (Tisseel und Artiss)
- Intensivmedizin (Regiocit)
Eine detaillierte Liste mit den von Baxter betroffenen Arzneimitteln finden Sie HIER.
Unsere parenteralen Ernährungslösungen sind zwar verschreibungspflichte Arzneimittel, stehen jedoch auf der Ausnahmeliste (sog. „White List“) und sind somit nicht von der neuen Richtlinie betroffen.
Was ist die Arzneimittel-Fälschungsschutz-Richtlinie?
Die WHO (Weltgesundheitsorganisation) geht davon aus, dass in den Entwicklungs- und Schwellenländern jede zehnte Arzneimittelpackung ohne Wirkstoff oder minderwertig ist. Auch Europa und Deutschland sind nicht davor gefeit, dass gefälschte Arzneimittelpackungen in die Lieferkette gelangen. Um diese Möglichkeit zu unterbinden und damit lebensbedrohlichen Schaden von Patienten fernzuhalten, hat die Europäische Union im Jahr 2011 die Fälschungsschutzrichtlinie 2011/62/EU und im Jahr 2016 die zugehörige delegierte Verordnung (EU) 2016/161 erlassen.
Was beinhaltet die Arzneimittel-Fälschungsschutz-Richtlinie?
Jede einzelne in Verkehr gebrachte Arzneimittelpackung erhält eine individuelle Serialisierungsnummer. Diese wird zusammen mit dem Verfalldatum, dem Produktcode (in Deutschland ist darin die Pharmazentralnummer, PZN, enthalten) und der Chargennummer in einem Data-Matrix-Code (zweidimensionaler Barcode) auf jede Packung aufgebracht. Außerdem muss jede Packung mit einem Erstöffnungsschutz (=Originalitätsverschluss) versehen sein. Die Serialisierungsnummer und der immer dazugehörige Originalitätsverschluss werden als Sicherheitsmerkmal bezeichnet. Dadurch ist es möglich, die Herkunft und die Echtheit jeder einzelnen Packung zu verifizieren. Von der FMD betroffen sind die meisten verschreibungspflichtigen Arzneimittel.
Welche Grundlage hat die Arzneimittel-Fälschungsschutz-Richtlinie?
Die Grundlage für das Fälschungsabwehrsystem sind die EU-Richtlinie zur Bekämpfung von Arzneimittelfälschungen von 2011 und eine zugehörige delegierte Verordnung von 2016. Neben dem geschilderten Abwehrsystem verlangen sie auch, dass verschreibungspflichtige Arzneimittel mit einem Erstöffnungsschutz (= Originalitätsverschluss) versehen werden.
Wie erfolgt die Umsetzung der Richtlinie?
Für die Umsetzung der FMD ist in Deutschland die Organisation securPharm mit Ihren Unterorganisationen zuständig. Die pharmazeutischen Unternehmer sind verpflichtet, mit securPharm einen Vertrag abzuschließen und die von ihnen produzierten verifizierungspflichtigen Packungen in einer zentralen Datenbank („EU Hub“) zu registrieren. Wird nun eine Packung mit Data-Matrix-Code in einer Apotheke an Patienten abgegeben, wird diese gescannt und es erfolgt via Internet ein Abgleich mit der Datenbank. Nur wenn die Apotheke die Rückmeldung erhält, dass die abzugebende Packung registriert und damit echt ist, darf diese an Patienten abgegeben werden. Dieses Prüfverfahren wird als „Ende-zu-Ende-Verifizierung“ bezeichnet.
Bei weiteren Fragen hilft Ihnen unsere Serviceline gerne weiter:
Baxter Serviceline
T +49 89 317 010
F +49 89 317 011 77
E-Mail
Servicezeiten:
Mo – Fr: 08.00 – 18.00 Uhr
Über Baxter
Seit 1960 kommen jeden Tag Tausende von Menschen mit Baxter Deutschland in Berührung. Unsere Produkte und Therapien sind überall dort im Einsatz, wo Leben gerettet und wieder lebenswert gemacht werden: in Krankenhäusern, Zentren, Arztpraxen und bei den Menschen zu Hause. Unser Portfolio umfasst die Heim- und Zentrumsdialyse sowie Akut Dialyse, Infusionssysteme und -geräte, Zytostatika, Parenterale Ernährung, Produkte für die Chirurgie, Anästhetika, Automatisierungssysteme sowie Dienstleistungen für die Apotheke.
Weitere Informationen finden Sie unter www.baxter.de